

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




一、支原体简单介绍
1.形态特征
支原体是一类没有细胞壁、高度多形性、能通过滤菌器、可用人工培养基培养增殖的最小原核细胞型微生物,大小为0.1-0.3微米。由于能形成丝状与分枝形状,故称为支原体。
2.生化分型
常利用发酵葡萄糖、水解精氨酸、水解尿素等生化反应鉴别支原体。 一般能分解葡萄糖的支原体则不能利用精氨酸,如肺炎支原体;能利用精氨酸的支原体则不能分解葡萄糖,如口腔支原体、人型支原体;解脲支原体不能利用葡萄糖或精氨酸,但可利用尿素作能源。
3.培养特性
支原体对营养需求较高,一般需要在培养基中添加一定比例的动物血清,大多数兼性厌氧,有些菌株在初分离时加入5%CO2生长更好。支原体生长缓慢,在琼脂含量较少的固体培养基上培养会出现典型的“荷包蛋样”,核心部分较厚,向下长入培养基,周边为一层薄的透明颗粒区。
4.抵抗力
支原体对热的抵抗力与细菌相似。对环境渗透压敏感,渗透压的突变可致细胞破裂。对重金属盐、石炭酸、来苏尔和一些表面活性剂较细菌敏感,但对醋酸铊、结晶紫和亚锑酸盐的抵抗力比细菌大。对影响细胞壁合成的抗生素如青霉素不敏感。
二、 二、口腔支原体检验依据及原理
支原体广泛存在于人和动物体内,是生物制品细胞培养生产工艺中常见的污染物,2020年版《中华人民共和国药典》要求使用精氨酸支原体培养基培养检测口腔支原体。具体操作要求为:将口腔支原体稀释至10-3-10-5,接种在精氨酸支原体肉汤培养基内,每个稀释度接种3支试管,置36℃培养7-14天,观察培养基变色结果。口腔支原体可以利用培养基中的精氨酸,使培养基pH值升高,遇指示剂酚红使培养基变红。培养基中的猪胃消化粉、牛肉浸粉、酵母浸粉提供碳源、氮源、生长因子,氯化钠维持渗透压,酚红为酸碱指示剂。
三、培养基配方(g/L):
|
猪胃消化粉 |
10.0 |
|
牛肉浸粉 |
5.0 |
|
酵母浸粉 |
5.0 |
|
氯化钠 |
2.5 |
|
葡萄糖 |
1.0 |
|
L-精氨酸 |
2.0 |
|
酚红 |
0.02 |
|
pH值7.1±0.2(25℃) |
|
四、口腔支原体固体平板法的具体操作步骤及培养结果
1.液体培养基活化
吸取保存的口腔支原体原液100uL,加入到精氨酸支原体肉汤培养基中,封口膜缠住管口,37度需氧培养3-4天,可发现培养管澄清且变红。说明有支原体生长且无杂菌污染。如下图所示:

口腔支原体液体培养结果
2.固体培养基二次活化
吸取经过初次活化的支原体培养液100uL,涂布于精氨酸支原体固体培养基平板上,封口膜包住平板边缘,37度培养6-10天,直到在光线下可以看到如下图所示的针尖大小的菌落。
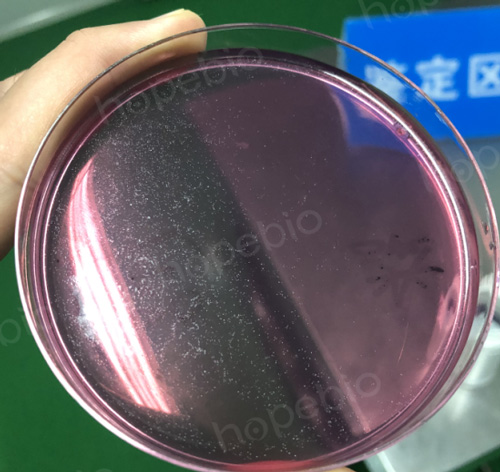
口腔支原体固体培养结果
五、口腔支原体常规切片观察
用消毒的小刀切割下一小块琼脂块,放于载玻片上,低倍镜下观察,可看到支原体呈现典型的"荷包蛋样"菌落,核心部分较厚,向下长入培养基,周边为一层薄的透明颗粒区。

口腔支原体切片观察
 |
 |
|
口腔支原体镜检结果观察(低倍镜) |
口腔支原体镜检结果观察(高倍镜) |
六、口腔支原体染色步骤及镜检结果
为了增加颜色的对比度,更好的观察检测支原体,可采用加染色液的方式对支原体进行染色。中国药典采用的为指示细胞培养法即DNA染色法,需要借助特殊的荧光染料和荧光显微镜进行观察。而一般的实验室并不具备这样的条件,因此可以使用一种更为简单的染色方法,借助两种常见的染液及普通电子显微镜即可观察。具体步骤为:将蕃红染液或结晶紫染液稀释10倍左右,直接加入到平板上染色10秒,之后用水冲洗掉,用小刀切割一块琼脂块上显微镜观察,可看到如下图所示,染色使支原体更加清晰,明显。下图分别为蕃红染色和结晶紫染色结果。
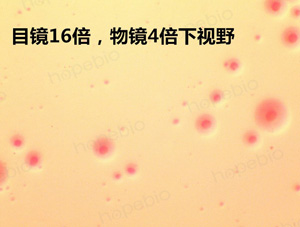
口腔支原体蕃红染色结果
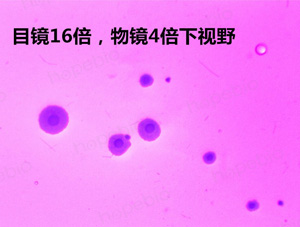
口腔支原体结晶紫染色结果(低倍镜)
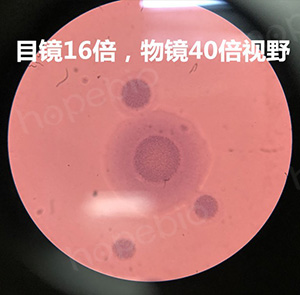
口腔支原体结晶紫染色结果(高倍镜)
七、整个操作过程中的注意事项
1.染液必须要稀释,且染色时间不易过长,否则染色太深,观察效果不好。
2.平板可以倒薄一些,这样切割下来的琼脂块会比较薄,便于光线的透过,观察起来也会更加清晰明亮。
3.不建议用菌液直接滴加到载玻片上,因为菌液本身含菌量太少,实测含菌量一般低于103/mL,因此难以快速发现支原体,且支原体为无色,与培养液混合后更难以在显微镜镜下找到。
4.固体培养基加血清倒板后,一定注意整个平板要完全透明无气泡无杂质,如果平板状态不好,会对后期结果的观察造成干扰。
相关产品:
注:本文属海博生物原创,未经允许不得转载。
上一篇:微生物盲样检测介绍及注意事项
下一篇:专性厌氧菌的培养方法及注意事项



