

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




1 范围
本标准规定了水产品中创伤弧菌( Vibrio vulnificus )的检验方法。
本标准适用于鱼、虾、蟹、贝类等水产品中创伤弧菌的检验。
2 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
2.1 恒温培养箱:36士1℃。
2.2 冰箱:2-5℃.7-10℃。
2.3 恒温水浴锅。
2.4 均质器或无菌研钵。
2.5 天平:感量0.1 g。
2.6 PCR仪。
2.7 电泳仪或毛细管电泳仪。
2.8 凝胶电泳成像系统或紫外检测仪。
2.9 生物安全柜。
2.10 高速离心机(最大转速至少15000r/min)。
2.11 涡旋振荡器。
2.12 微量可调移液器(量程2.5μL.10μL、100μL、1000μL)及配套吸头。
2.13 精密pH试纸或pH计。
2.14 无菌试管:规格18mmX180mm和15 mmX 100 mm。
2.15 无菌吸管:规格1 mL(具0.01ml刻度)和10mL(具0.1mL刻度)。
2.16 无菌锥形瓶:容量250mL、500ml和1000ml。
2.17 无菌培养皿:直径90 mm。
2.18 无菌手术剪、镊子、钳子等。
2.19 PCR反应管。
3 培养基和试剂
3.1 蛋白胨-氯化钠-纤维二糖-多黏菌素E(PNCC)增菌液。
3.2 纤维二糖-多黏菌素E(CC)琼脂培养基。
3.3 改良纤维二糖-多黏菌素B-多黏菌素E(mCPC)琼脂培养基。
3.4 3%氯化钠胰蛋白胨大豆琼脂培养基。
3.5 磷酸盐缓冲液(PBS)。
3.6 3%氯化钠三糖铁琼脂斜面。
3.7 嗜盐性试验培养基。
3.8 3%氯化钠赖氨酸脱羧酶试验培养。
3.9 3%氯化钠MR-VP培养基。
3.10 3%氯化钠溶液。
3.11 氧化酶试剂。
3.12 革兰氏染色液。
3.13 邻硝基酚-β-D-半乳糖苷(ONPG)试剂。
3.14 Voges-Proskauer(V-P)试剂。
3.15 细菌DNA提取试剂盒。
3.16 生化鉴定试剂盒。
3.17 PCR反应配套试剂。
3.18 琼脂糖凝胶电泳配套试剂。
3.19 具有菌种保藏资质单位提供的创伤弧菌标准菌株。
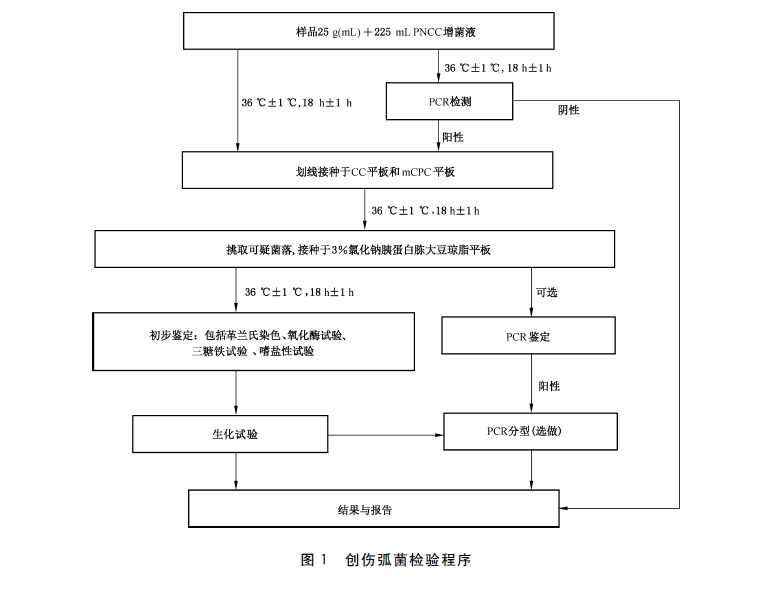
4 检验程序
创伤弧菌检验程序见图1。
5 操作步骤
5.1 样品制备
5.1.1 新鲜样品采集后应于3h内完成检验,若不能在规定时间内完成,则将样品置于7℃-10℃条件下保存(因创伤弧菌在4℃条件下极易形成活而不可培养的状态,因此样品勿放4℃条件下),并尽可能在24h内完成检验;冷冻样品应在不超过45℃的温热条件下解冻,解冻时间不超过15min。
5.1.2 取样:鱼类和头足类取其表面组织、肠和鰓。贝类则取全部内容物(包括贝肉和体液)。甲壳类取整个动物或其中心部分(包括肠和鰓)。如为带壳贝类或硬壳甲壳类,则应先用流动自来水冲洗外壳并用滤纸吸干表面水分,然后无菌操作打开外壳,按上述要求取相应部分。
5.1.3 以无菌操作取上述处理后的样品25 g,加人PNCC增菌液225 mL,用旋转刀片式均质器以8000 r/ min均质1 min,或用拍击式均质器均质2 min,充分混匀制备成1 : 10的样品匀液。如无均质器,则将样品放人无菌乳钵中充分研磨,取磨碎后的样品25 g转人500 ml无菌锥形瓶中,加入PNCC增菌液225 mL,充分振荡混匀,制备成1 : 10的样品匀液。
5.2 增菌将5.1.3制备的1 : 10样品匀液于36士1℃培养18h士1h。
5.3 PCR检测
PCR实验环境条件和过程控制应参照GB/T 27403《实验室质量控制规范食品分子生物学检测》规定执行,下同。
5.3.1 DNA模板的制备
在距离PNCC增菌液的液面下1 cm处吸取1 mL置于1.5 mL EP管中,9000r/min离心3 min,弃去上清液。向沉淀中加入1 ml PBS将其悬浮并充分清洗后,9000r/min离心3 min,弃去上清液,按此步骤反复清洗沉淀2次~3次,弃去最后一遍上清液,加入1 ml无菌超纯水,100℃煮沸10 min,继而12000r/min离心5min,上清液用于PCR分析。若不能及时分析则于一20C保存备用。也可以用商品化的DNA提取试剂盒按其说明书要求提取制备DNA模板。
5.3.2 PCR扩增
5.3.2.1 引物
信息见表1。

5.3.2.2 对照设置
每次PCR反应使用创伤弧菌标准菌株作为阳性对照,同时,使用除创伤弧菌之外的其他弧菌的标准菌株作为阴性对照,以灭菌去离子水作为空白对照。
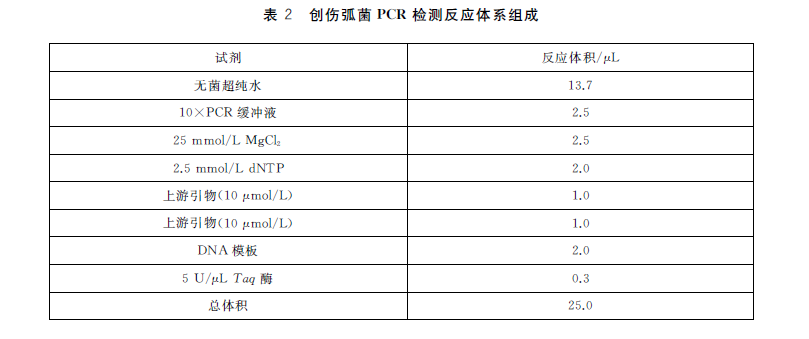
5.3.2.3 PCR反应体系
见表2。
5.3.2.4 PCR反应程序
预变性:94℃、5min;变性:94℃、1min;退火:62℃、1min;延伸:72℃、1min;循环数:30;终延伸:72℃、10 min;电泳检测。若不能立即检测则4℃保存备用。
5.3.3 电泳
凝胶电泳检测PCR扩增产物。用0.5 X TBE缓冲液配制1.5%的琼脂糖凝胶(含EB 0.5 rg/mL或Goldview 5 μL/100 ml或Gelred 5 μL/50 ml等DNA染料),取5 μL. PCR扩增产物与1 μl. 6X核酸电泳上样缓冲液混合后,点样,同时有一孔加入DNA分子量标准(范围为100 bp~1000 bp)。根据以下公式:电泳槽正负极的距离(cm)X5V/em计算并设置电压,使用0.5XTBE缓冲液恒压电泳,根据溴酚蓝的移动位置确定电泳时间,使用凝胶成像系统或紫外检测仪观察和记录结果。
5.3.4 结果判定
质控系统:阴性对照和空白对照均未出现扩增条带,阳性对照出现预期大小(519 bp)的扩增条带,则检测系统正常。否则,任-种对照如果出现非上述正常结果,应重做实验,同时排除污染因素。
阳性结果:在质控系统正常的情况下,待测样品出现预期大小(519bp)的扩增条带,判定PCR结果为阳性。
阴性结果:在质控系统正常的情况下,待测样品未出现预期大小(519bp)的扩增条带,判定PCR结果为阴性。
5.4 分离
用10 μL接种环在距离PNCC增菌液的液面下1 cm沾取- -环增菌液,分别划线接种于CC和mCPC平板,于36℃士1℃条件下培养18 h士1h。典型的创伤弧菌在CC和mCPC平板上的形态为:圆形、扁平,光照下呈透明或中心不透明但边缘透明的黄色至橘黄色菌落,菌落直径1mm~2mm,菌落周围可出现(或不出现)黄色晕圈。
5.5 分纯培养
从CC平板和mCPC平板上各挑取至少5个创伤弧菌可疑菌落(少于5个时全选),分别接种于3%氯化钠胰蛋白胨大豆琼脂平板,36℃士1℃培养18h士1h后用于后续鉴定。创伤弧菌在3%氯化钠胰蛋白胨大豆琼脂平板.上的菌落形态为圆形、乳白色、湿润、隆起、直径1 mm~2mm。
5.6 鉴定
创伤弧菌可采用菌落特征结合生化特性或PCR方法进行鉴定。
5.6.1 菌落特征及生化特性
5.6.1.1 初步鉴定
该步骤用于创伤弧菌的初步鉴定,进行以下4项鉴定实验时,挑取的菌落应来自分纯后的同一个单菌落。
a)革兰氏染色镜检:从5.5中3%氯化钠胰蛋白胨大豆琼脂平板上挑取创伤弧菌疑似菌落进行革兰氏染色并镜检。创伤弧菌为革兰氏阴性,显微镜下菌体为棒状、弧状、卵圆状等多种形态,无芽胞。
b)氧化酶试验:用接种环从5.5中3%氯化钠胰蛋白胨大豆琼脂平板上挑取创伤弧菌疑似菌落适量,涂布在用氧化酶试剂润湿(如无菌滤纸)或滴有氧化酶试剂的白色或无色载体上(如载玻片)。如果涂菌部位在10 s之内变紫色(偶有蓝紫色),即为氧化酶试验阳性,不变色为氧化酶试验阴性。创伤弧菌为氧化酶试验阳性。
c)三糖铁试验:用接种针从5.5中3%氯化钠胰蛋白胨大豆琼脂平板上挑取创伤弧菌疑似菌落适量,转种于3%氯化钠三糖铁琼脂斜面并穿刺底层(注意接种针不要触及试管底部),36℃士1℃培养24h观察结果。创伤弧菌在3%氯化钠三糖铁琼脂斜面中生长时试管底层变黄,无气泡,斜面颜色不变黄(偶有斜面颜色变黄现象)。
d)嗜盐性试验:用接种针从5.5中3%氯化钠胰蛋白胨大豆琼脂平板上挑取创伤弧菌疑似菌落,分别接种于含0%、3% .6%、8%和10%氯化钠的胰蛋白胨水中,36℃士1℃培养24h,观察液体的混浊情况。创伤弧菌在含0% .8%和10%氯化钠的胰蛋白胨水中不生长或微弱生长,胰蛋白胨水澄清透亮或稍混浊.而在含3%和6%氯化钠的胰蛋白胨水中生长旺盛,胰蛋白胨水混浊。
5.6.1.2 确证实验
将初步鉴定为创伤弧菌的疑似菌落接种在3%氣化钠胰蛋白胨大豆琼脂平板上,36℃士1℃培养18h士1h后,取纯培养物分别接种于含3%氯化钠的赖氨酸脱羧酶试验培养基和MR-VP培养基中,36℃士1 ℃培养24 h~48 h后观察结果;另取少许纯培养物接种于3%氯化钠三糖铁琼脂斜面,36℃士1℃培养18h后用于ONPG试验。也可选择生化鉴定试剂盒进行鉴定。
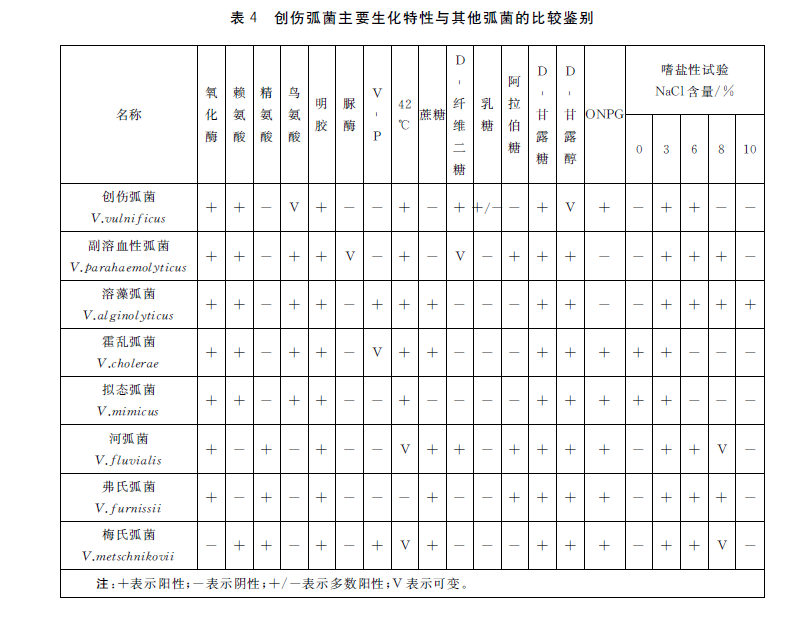
创伤弧菌生化特性见表3,与其他弧菌的鉴别见表4。

5.6.2 PCR鉴定
本部分试验可替代5.6.1用于创伤弧菌的快速鉴定。
5.6.2.1 DNA模板的制备
从5.5中3%氯化钠胰蛋白胨大豆琼脂平板.上挑取创伤弧菌疑似菌落,转至500 μL无菌超纯水中,充分混匀后制成肉眼可见的混浊菌悬液,煮10min,12000r/min离心5min,取上清液用于PCR分析。若不能及时分析则于一20℃保存备用。也可以用商业化的DNA提取试剂盒按其说明提取制备DNA模板。
5.6.2.2 PCR扩增和电泳
同5.3.2和5.3.3。
5.6.2.3 结果判定
质控系统:阴性对照和空白对照均未出现扩增条带,阳性对照出现预期大小(519 bp)的扩增条带,则检测系统正常。否则,任一-种对照如果出现非_上述正常结果,应重做实验,同时排除污染因素。
阳性结果:在质控系统正常的情况下,待测样品出现预期大小(519bp)的扩增条带,判定PCR结果为阳性,该菌株是创伤弧菌。
阴性结果:在质控系统正常的情况下,待测样品未出现预期大小(519bp)的扩增条带,判定PCR结果为阴性,该菌株不是创伤弧菌。
5.7 创伤弧菌分型(选做)
5.7.1 DNA模板的制备
取鉴定结果为创伤弧菌的菌株制备DNA模板,制备方法同5.6.2.1。
5.7.2 PCR扩增
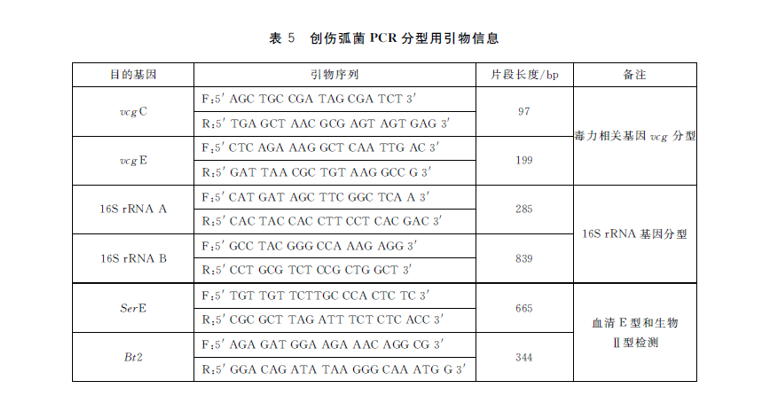
5.7.2.1 引物
PCR分型用引物信息见表5。
5.7.2.2 对照设置
每次PCR反应使用含有目的基因的创伤弧菌标准菌株作为阳性对照,同时,使用除创伤弧菌之外的其他革兰氏阴性菌标准菌株作为阴性对照,以灭菌去离子水作为空白对照。
5.7.2.3 PCR反应体系.
同表2。
5.7.2.4 PCR反应程序
预变性:94℃、5min;变性:94℃.1min;退火:55℃(vcg基因)、58℃ (16S rRNA基因)、64℃(Bt2基因及SerE基因)1min;延伸:72℃.1min;循环数:30个循环(vcg基因及16S rRNA基因)、
35个循环(Bt2基因及SerE基因);终延伸:72℃、5 min;电泳。若不能及时电泳检测,则将扩增产物于4℃短期(1 d~2 d)储存。
5.7.3 电泳
同5.3.3。
5.7.4 结果判定
质控系统:阴性对照和空白对照均未出现扩增条带,阳性对照出现预期大小的扩增条带,则检测系统正常。否则,任--种对照如果出现非上述正常结果,应重做实验,同时排除污染因素。在质控系统正常的情况下,如果待测菌株出现97 bp大小的条带,则判定该株创伤弧菌为vcg℃型;如果出现199 bp大小的条带,则判定该株创伤弧菌为vcg E型;
如果待测菌株出现285bp大小的条带,则判定该株创伤弧菌为16SrRNAA型,如果出现839bp大小的条带,则判定该株创伤弧菌为16SrRNAB型,如果同时出现285bp大小和839bp大小的两条带,则判定该株创伤弧菌为16SrRNAA/B型;
如果待测菌株出现665 bp大小的条带,则判定该株创伤弧菌为血清E型;如果待测菌株出现344 bp大小的条带.则判定该株创伤弧菌为生物1I型。
6 结果与报告
根据菌落特征、生化特性或PCR鉴定结果,报告25g样品中检出或未检出创伤弧菌。
附:GB4789.44-2020 创伤弧菌检验标准 点击下载
附:GB4789.44 创伤弧菌检测用培养基核算表 点击下载
蛋白胨-氯化钠-纤维二糖
-多粘菌素E(PNCC)增菌液
GB4789.44 创伤弧菌检测用培养基核算表
用途
货号
名称
规格
称量数
需求
每瓶/盒/包可做配制
单价
前增菌
HB9174
250g
60g/升
每个样品225ml
每瓶可倒18个样
120
添加剂
HB9174a
PNCC添加剂
4.5ml*10支
220.5ml里加一支
每250g需配2盒
150
或即用型
HBJ019
225ml*10袋
无需另外加入添加剂
200
分离
HB4151
MCPC培养基
250g
50.08g/900ml
每个平板20ml
每瓶可倒224个平板
120
添加剂
HB4151a
MCPC添加剂
1ml*5
100ml加入1支,每250g需10盒
每盒可倒25个平板
80
HB4151b
10%纤维二糖
5ml*10
100ml加入2支,每250g需10盒
每盒可倒25个平板
210
或即用型
HBPM4151
MCPC培养基平板
9ml*10
每个样品需1个平板
200
分离
HB4151-2
纤维二糖-多粘菌素E琼脂
250g
50.08g每升
每个平板20ml
每盒可倒140个平板
120
添加剂
HB4151-1a
CC琼脂添加剂
1ml*5
100ml加入1支,每250g需10盒
每盒可倒25个平板
40
HB4151b
10%纤维二糖
5ml*10
100ml加入2支,每250g需10盒
每盒可倒25个平板
210
纯化
HB8631
3%氯化钠胰蛋白胨大豆琼脂
250g
65g每升
每个平板20ml
每盒可倒190个平板
95
或即用型
HBPM8631-1
3%氯化钠胰蛋白胨大豆琼脂平板
9ml*10
每个疑似菌接种一个平板
每包10个平板
70
穿刺试验
HB4088-3
3%氯化钠三糖铁(TSI)琼脂
250g
89.5g/升
每个斜面5ml
每瓶可做270-400个斜面
90
或即用型
HBPT008-1
3%氯化钠三糖铁管
20支
160
生化
HBIG10
HBI创伤弧菌成生化鉴定条
5条/盒
每盒可接5个菌
175
上一篇:霍乱弧菌检验标准操作程序



